Bài 37: Etilen
-
- GDĐT Việt Nam
- 26/05/2023 - Xem: 1372

Ethylen, có công thức hóa học là CH2=CH2, là chất đầu tiên trong dãy đồng đẳng hydrocarbon alken. Đây là hợp chất hữu cơ được sản xuất nhiều nhất trên thế giới
1. Tính chất vật lý
- Etilen (C2H4) là một hydrocacbon không màu và không mùi. Dưới điều kiện thường, etilen tồn tại dưới dạng khí
- Etilen có nhiệt độ nóng chảy và nhiệt độ sôi thấp
- Etilen hòa tan tốt trong các dung môi không phân cực như ete, benzen và các dung môi hữu cơ khác. Tuy nhiên, etilen không hòa tan trong nước do tính không phân cực của nó.
- Etilen là một chất dễ bị ôxi hóa. Khi tiếp xúc với không khí hoặc các chất oxy, etilen có thể bị ôxi hóa thành axit axetic.
- Etilen là một chất khá dễ cháy và có thể tạo ra ngọn lửa mạnh khi tiếp xúc với nguồn lửa, điện cực nóng hoặc chất oxi. Nó có thể tỏa ra nhiệt lượng cao và tạo ra khí carbon đen trong quá trình cháy.
- Etilen nhẹ hơn không khí
2. Cấu tạo phân tử
Trong phân tử etilen mỗi nguyên tử cacbon liên kết với 2 nguyên tử H, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
Etilen có công thức cấu tạo: 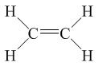 Viết gọn là: CH2 = CH2
Viết gọn là: CH2 = CH2
Như vậy, trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kêt này dễ đứt ra trong các phản ứng hóa học.
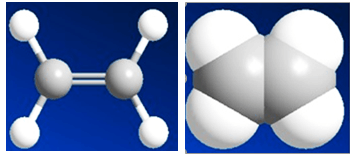
Hình 1: Mô hình phân tử etilen dạng rỗng và dạng đặc.
* Tác dụng với oxi:
Khi đốt khí etilen cháy tạo thành khí CO2, hơi nước và tỏa nhiều nhiệt.
Phương trình hóa học:
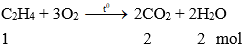
Nhận xét: Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
* Tác dụng với dung dịch brom
Phương trình hóa học:
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br
C2H4 + Br2 → C2H4Br2
Nhận xét:
– Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
– Phản ứng trên gọi là phản ứng cộng. Ngoài brom, trong những điều kiện thích hợp etilen có thể tham gia phản ứng cộng với Cl2, H2, HBr…
– Các chất có liên kết đôi như etilen dễ tham gia phản ứng cộng.
* Các phân tử etilen kết hợp với nhau
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác) các phân tử etilen kết hợp với nhau tạo ra chất có kích thước và khối lượng rất lớn gọi là poli etilen (PE).
Phương trình hóa học:
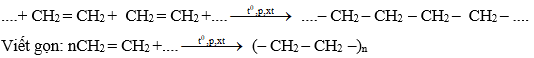
Chú ý:
- Phản ứng trên là phản ứng trùng hợp.
- Poli etilen là chất không tan trong nước, không độc, là nguồn nguyên liệu quan trọng trong công nghiệp chất dẻo.
* Etilen làm mất màu dung dịch KMnO4
2 CH2=CH2 + 2KMnO4 + 4H2O → + 2MnO2 + 2KOH (etylen glicol)
-Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
4. Ứng dụng của Etilen
Nhắc đến công dụng mà Etilen mang lại cho con người thì vô số kể với nhiều lĩnh vực khác nhau, điển hình như:
Dù đóng góp một phần không nhỏ đến đời sống con người và động – thực vật, song, chúng vẫn rất nguy hại nếu chúng ta không biết cách đối phó hay sử dụng C2H4 hay Etilen mà không hề có một kiến thức nào về nó.
5. Sự nguy hiểm của Etilen
6. Điều chế Etilen
CH3CH2OH → CH2=CH2 + H2O (to, H2SO4)
Đăng ký tài khoản ngay bây giờ để sử dụng các tiện ích chuyển đổi số của GDĐT Việt Nam.