Tổng hợp kiến thức Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa họcI. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
II. Cấu tạo bảng tuần hoàn
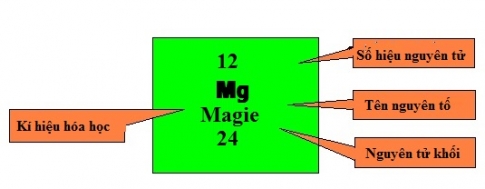
1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó
- Số hiệu nguyên tử có trị số bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử.
- Số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
2. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn hiện có 7 chu kì, các chu kì 1, 2, 3 là chu kì nhỏ; các chu kì 4, 5, 6, 7 là chu kì lớn.
3. Nhóm
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có sô electron lớp ngoài cùng bằng nhau, do đó có tính chắt tương tự nhau.
- Mỗi nhóm được xếp thành một cột theo chiều tăng của điện tích hạt nhân. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
- Số thứ tự của các nhóm A bằng số electrdn ở lớp ngoài cùng của nguyên tử trong nhóm đó.
III. Sự biển đổi tính chất của các nguyên tố trong bảng tuần hoàn
1. Trong một chu kì
- Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
- Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim tăng dần.
2. Trong một nhóm
- Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim của các nguyên tố giảm dần.
IV. Ý nghĩa của bảng tuần hoàn
- Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
- Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Copy & Share


