Bài 3: Tính chất hóa học của axit
-
- GDĐT Việt Nam
- 25/05/2023 - Xem: 854


Tổng hợp nội dung kiến thức bài 3:
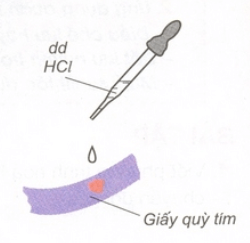
1. Axit làm đổi màu chất chỉ thị màu
- Dung dịch axit làm đổi màu quỳ tím thành đỏ.
Ví dụ:

2. Axit tác dụng với kim loại
- Dung dịch axit tác dụng được với nhiều kim loại tạo thành muối và giải phóng khí hiđro.
Ví dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
2HCl + Fe → FeCl2 + H2 (↑)
- Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl, H2SO4 loãng.
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng khí hiđro.
3. Axit tác dụng với bazơ: Axit + bazơ → muối + H2O
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
HCl + NaOH → NaCl + H2O
Phản ứng của axit với bazơ được gọi là phản ứng trung hòa.
4. Axit tác dụng với oxit bazơ: Axit + oxit bazơ → muối + H2O
Ví dụ:
6HCl + Fe2O3 → FeCl3 + 3H2O
H2SO4 + MgO → MgSO4 + H2O
Ngoài ra, axit còn tác dụng với muối.
Ví dụ:
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O
Dựa vào tính chất hóa học, axit được phân làm 2 loại:
+ Axit mạnh như HCl, H2SO4, HNO3,…
+ Axit yếu như H2S, H2CO3,…
Đăng ký tài khoản ngay bây giờ để sử dụng các tiện ích chuyển đổi số của GDĐT Việt Nam.